2025.10.23
由美國Portal公司開發的創新型遞送平臺Gateway™系統,基於先進的機械擠壓穿孔技術,不僅在造血幹細胞的工程化改造中表現出色,還能高效遞送多種RNA類載荷(包括mRNA、siRNA、saRNA等)。該系統在原代免疫細胞及幹細胞的多重遞送中展現出低毒性、高存活率與廣譜細胞兼容性的優勢,大幅簡化了細胞工程改造流程。
Gateway™:模塊化設計實現精準高效遞送
Gateway™系統由兩部分組成:主機控製單元采用緊湊型臺式設計,可精確控製輸送參數,且能輕松置於生物安全櫃內操作;MicroBooster™則是針對不同細胞類型優化設計的遞送芯片,具備特定孔徑結構,確保各類細胞均能實現更高效率的外源載荷處理。

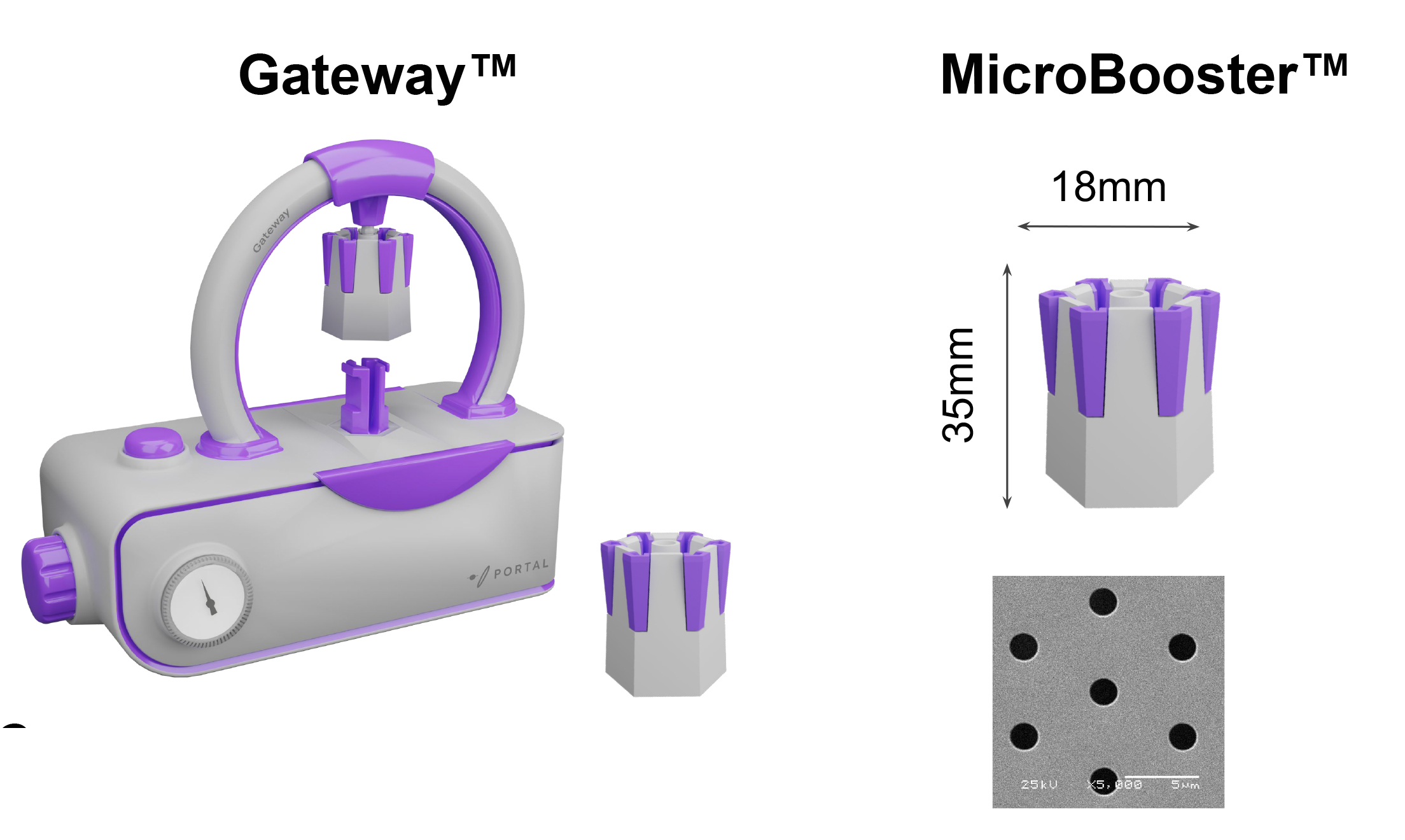
圖1. Portal機械擠壓穿孔技術工作原理
混合:將細胞與目標載荷(如 mRNA、RNP等)共同懸浮於溶液中;
擠壓:使細胞快速通過 Portal特殊設計的微流控芯片通道(孔徑約為細胞直徑的70%);
進入:細胞在物理擠壓下發生瞬時形變,形成可自我修復的孔隙,周圍目標分子順勢進入細胞質;
恢復:細胞膜迅速修復,細胞恢復完整狀態。
整個過程快速、溫和,無需化學試劑或病毒載體,也避免了電擊對細胞造成的應激與損傷。
實驗數據驗證:高效遞送與功能實現
1. 高效遞送mRNA至多種免疫細胞
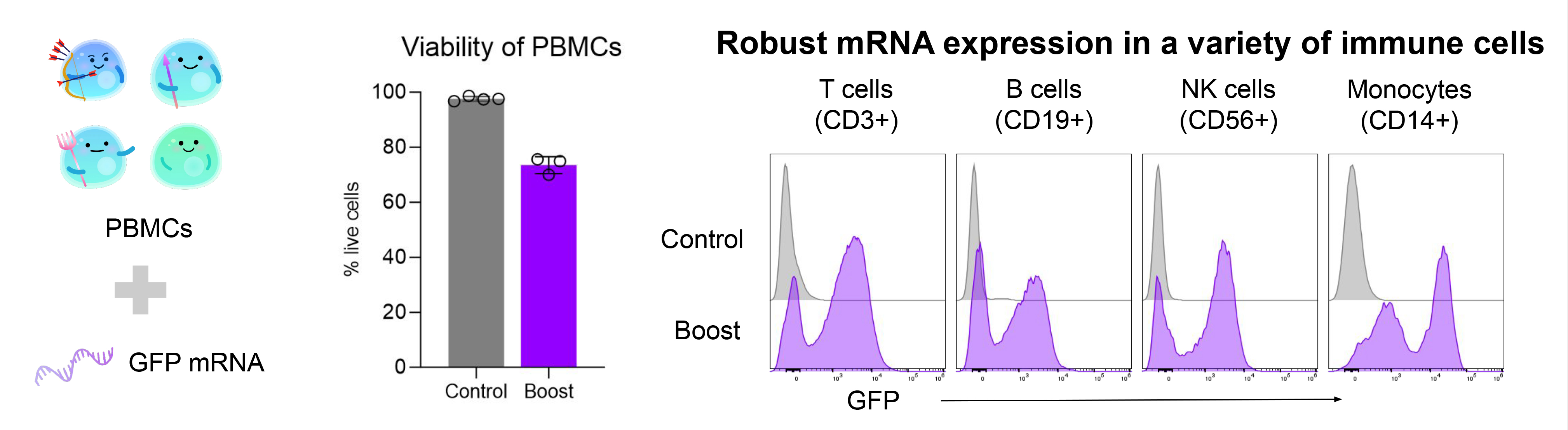
使用Gateway™系統向人類外周血單個核細胞 (PBMCs)遞送GFP mRNA 20小時後,流式細胞術檢測顯示細胞活性良好,且在T細胞、B細胞、NK細胞和單核細胞中均檢測到廣泛GFP表達。
2. 人類誘導多能幹細胞(iPSCs)中mRNA的高效表達
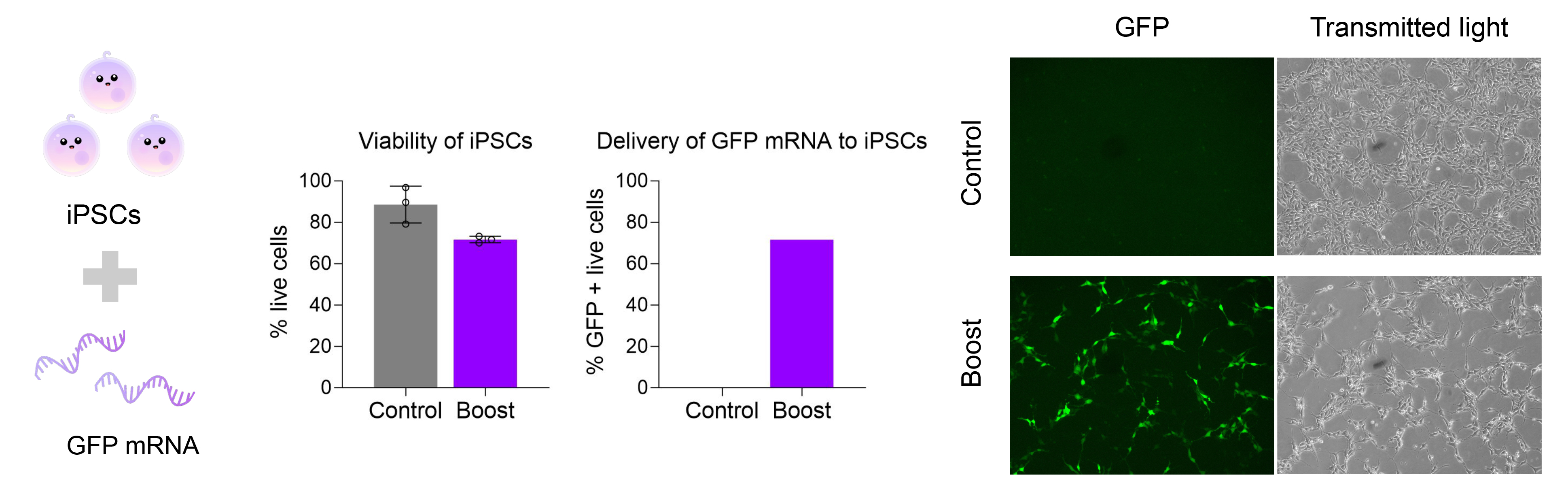
遞送GFP mRNA至人iPSCs 20小時後,通過熒光顯微鏡與流式細胞術均觀察到強GFP信號,細胞狀態保持穩定。
3. CD34+細胞中的基因敲低
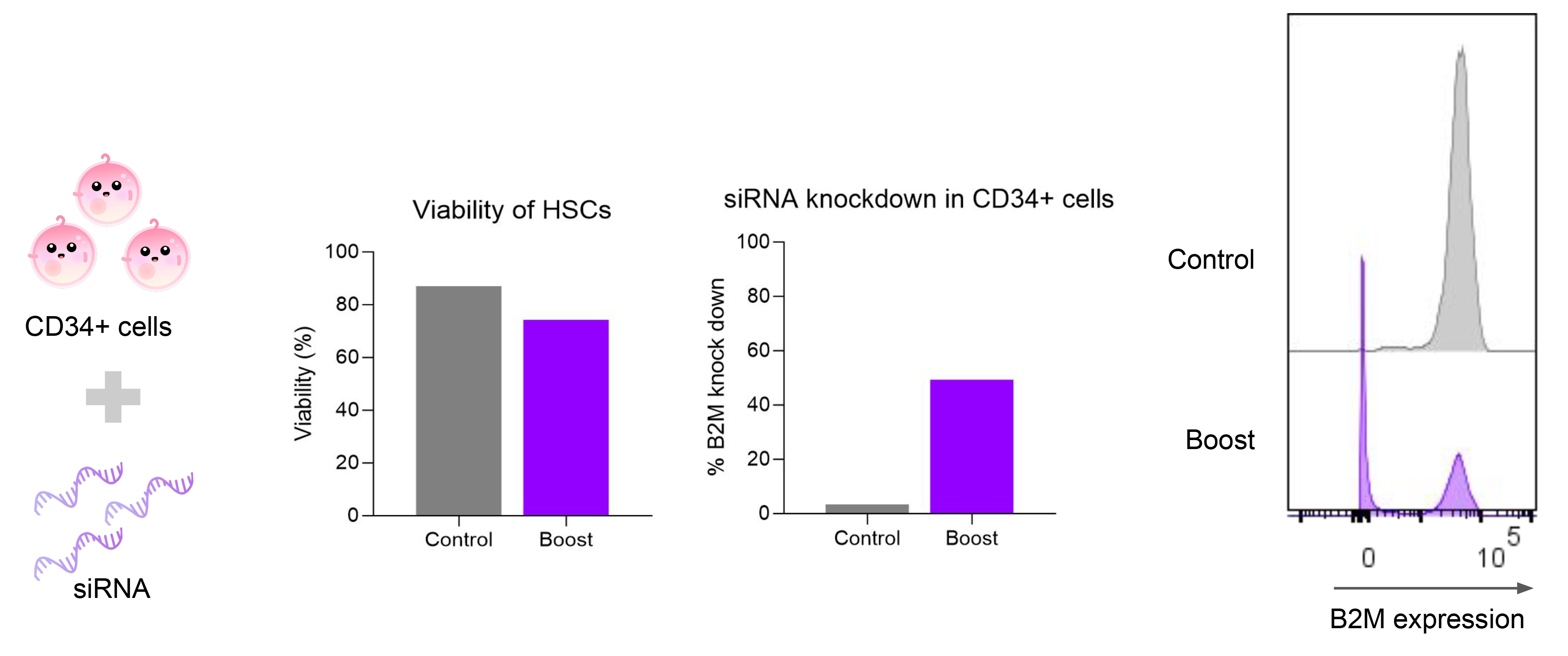
遞送B2M siRNA至人類CD34+造血幹細胞40小時後,流式細胞術顯示B2M表達顯著下降,同時細胞存活率維持較高水平。
4. 初始T細胞中的高效多重遞送
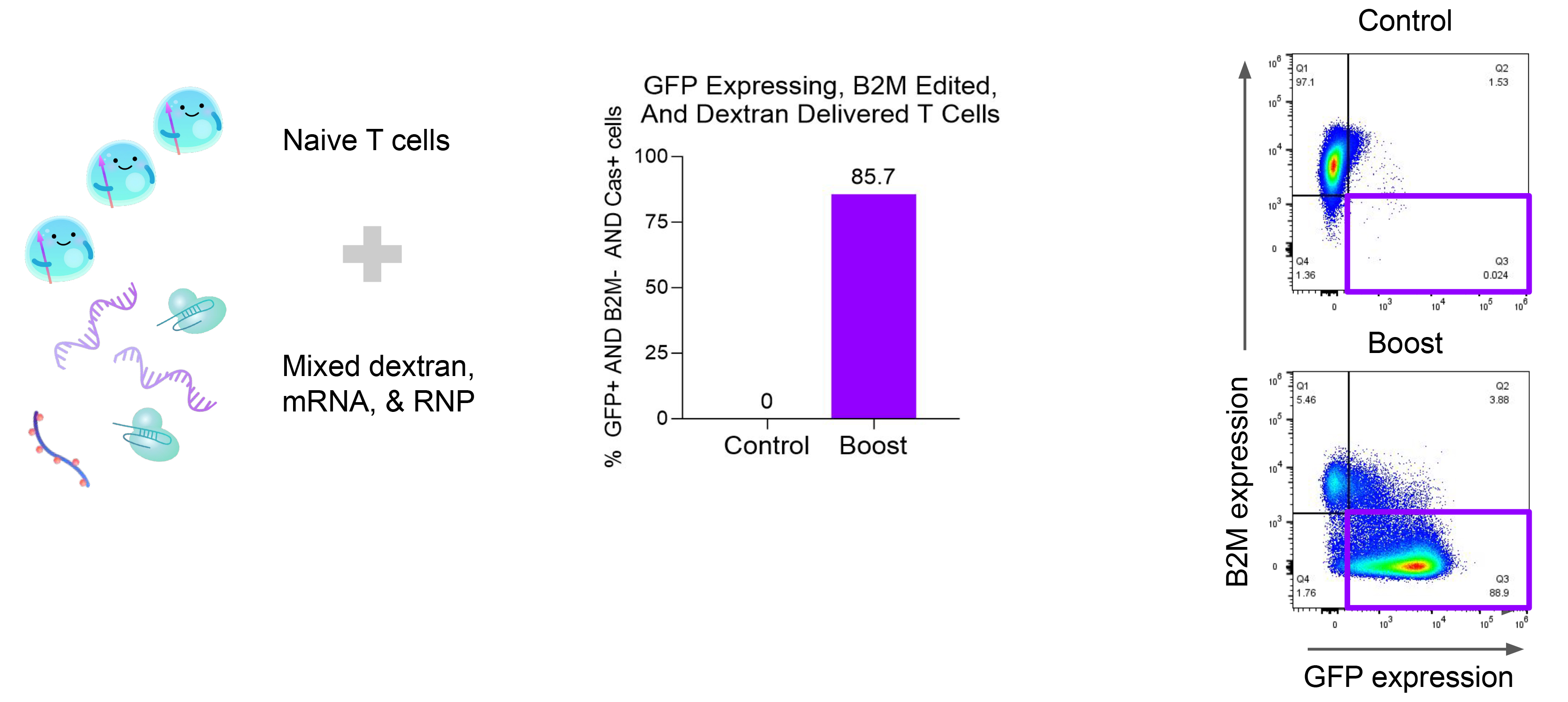
從外周血單個核細胞中分離出初始T細胞,將GFP mRNA、熒光標記的葡聚糖聚合物和β2微球蛋白(B2M)CRISPR RNPs等多重載體遞送至初始T細胞。40小時後,使用流式細胞術評估mRNA和B2M蛋白的表達,證實該系統支持高效多重遞送。
5. CAR-T功能驗證
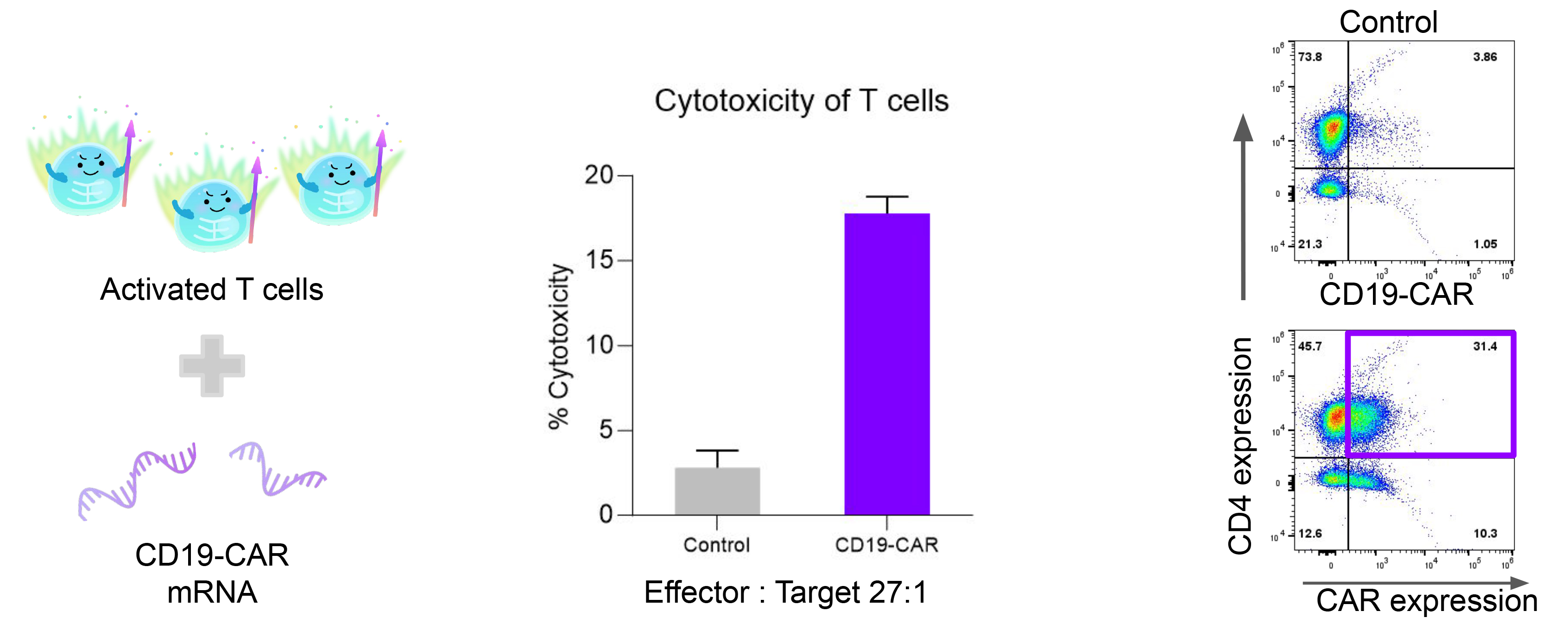
將CD19嵌合抗原受體(CAR)mRNA遞送至活化的T細胞中。轉染20小時後,采用流式細胞術檢測CD19 CAR的表達水平。隨後,將高表達CAR的T細胞與Raji細胞共培養,通過Cytotox96法檢測LDH釋放量,以評估CAR-T細胞的效應功能。
客戶應用案例
案例一:細胞重編程——驅動iPSC向神經元分化
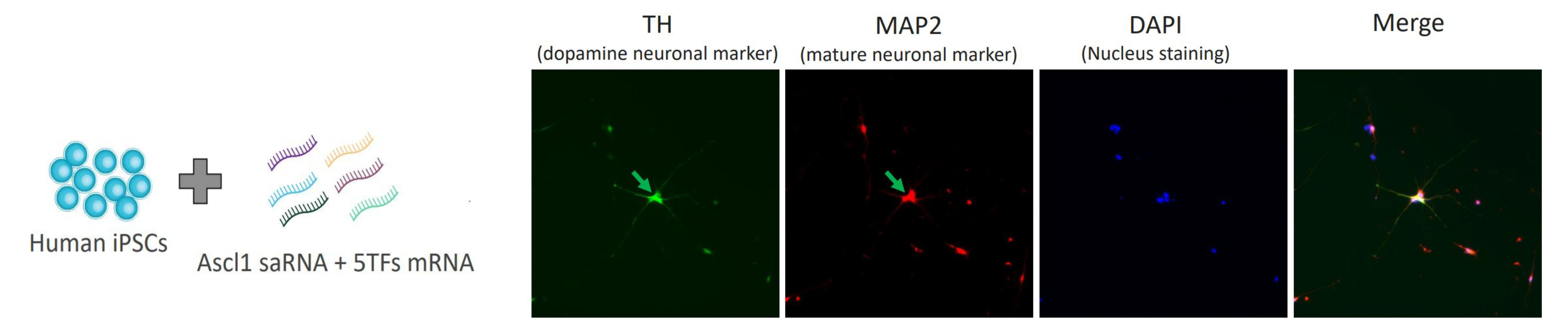
研究人員使用Gateway™系統將Ascl1 saRNA及神經元5種轉錄因子(FoxA2, Lmx1a, Nurr1, Pitx3, EN1))的mRNA遞送至誘導多能幹細胞(iPSCs)。14天後,細胞成功表達多巴胺能神經元標誌物酪氨酸羥化酶(TH)和成熟神經元標誌物MAP2(綠色箭頭所示),展現出神經元分化潛力。
案例二:減少預處理需求——增強HSC存活與歸巢能力
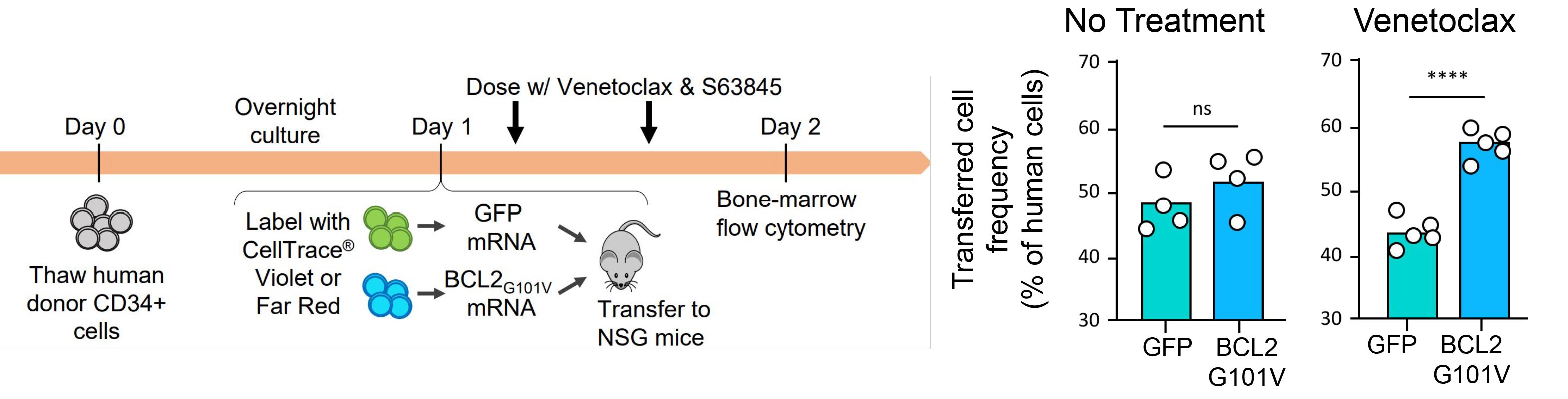
研究人員使用Gateway™系統將GFP或BCL-2(G101V)mRNA遞送至CD34+ HSC(造血幹細胞),並移植至NSG小鼠。結果顯示,突變BCL2能夠抵抗Venetoclax誘導的雕亡,顯著提升HSC存活與骨髓歸巢效率。
案例三:增強免疫細胞功能——改善T細胞表型與細胞毒性
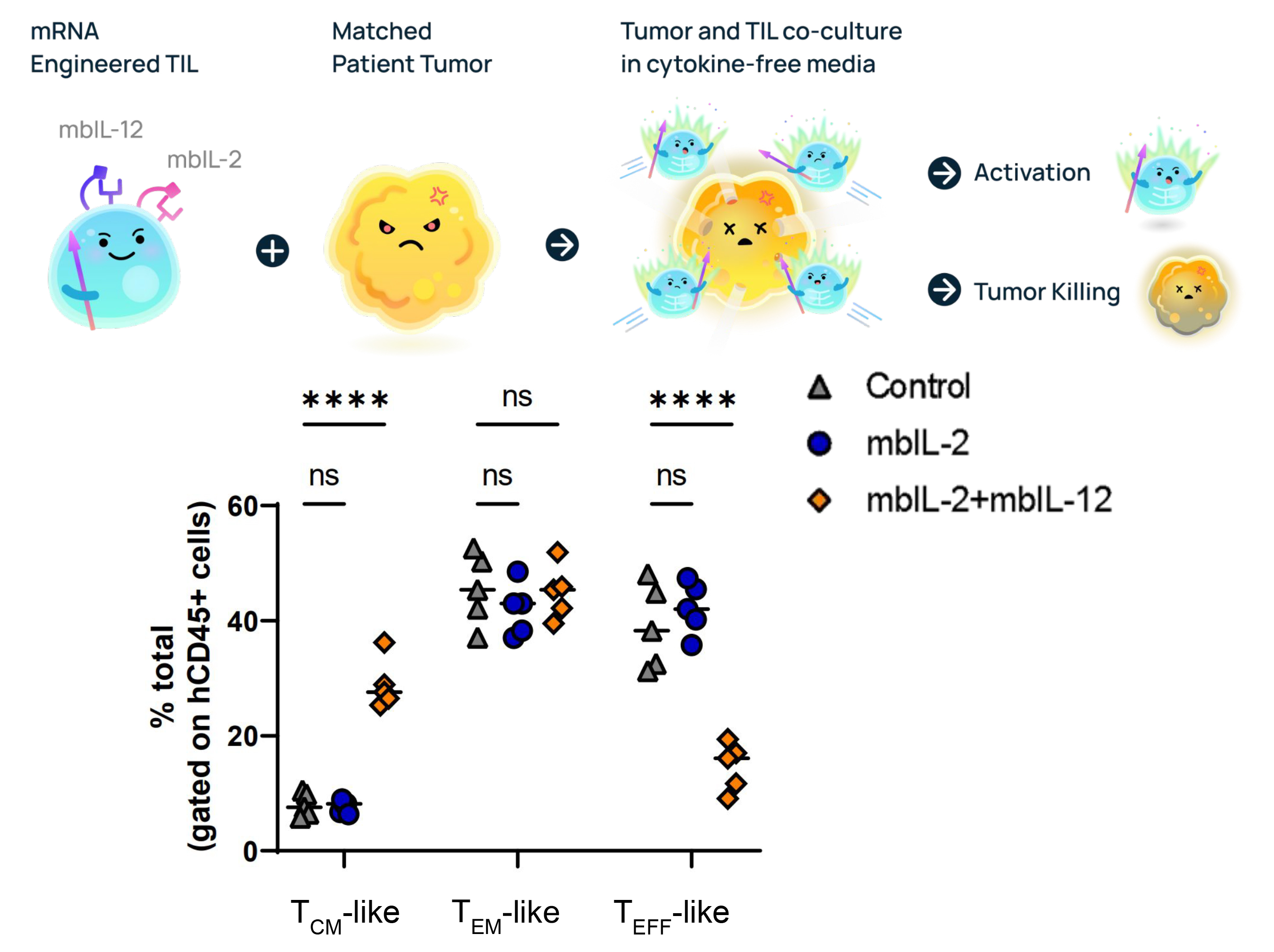
研究人員使用Gateway™系統將膜結合型IL-2/12 mRNA遞送至T細胞,並移植至小鼠模型。5天後血液檢測表明,mbIL-2/12 T細胞比例顯著增加,證實其在改善T細胞記憶表型和增強細胞毒性方面具有潛力。
Gateway™系統技術優勢
強大的核酸遞送能力:支持mRNA、siRNA、saRNA、DNA、RNP復合物等多種核酸類載荷,並可實現多重遞送;
廣泛的細胞兼容性:覆蓋難轉染的原代免疫細胞(T、B、NK、單核細胞)及幹細胞(iPSC、CD34+ HSC);
優異的細胞活性維持:低毒性、高存活率,保障細胞功能完整性;
便捷的流程整合:可無縫嵌入現有細胞生產流程,便於臨床及產業推廣。
未來展望
作為面向新一代細胞療法的先進技術,Gateway™系統在細胞治療、生物製造、再生醫學、診斷與分析以及高通量篩選等領域展現出巨大潛力。其在提升遞送效率、保障細胞活性及多重載荷兼容性方面的優勢,使其成為推動臨床轉化與產業化的關鍵工具,為未來精準醫療與規模化細胞工程提供堅實支撐。



