2025.09.05
在基因治療領域,尤其是針對血紅蛋白病等罕見遺傳病的治療中,基於基因編輯的自體造血幹細胞(HSCs)移植展現出巨大的治愈潛力。然而,HSCs 作為一種極為敏感且脆弱的細胞類型,其高效改造仍面臨多重挑戰:現有遞送技術毒性高、可遞送分子類型受限、難以實現規模化應用。
傳統電穿孔技術(Electroporation, EP)雖應用廣泛,卻容易造成明顯的細胞損傷,導致活力下降、基因表達異常,並影響其長期增殖與分化能力,嚴重限製了臨床轉化。美國Portal公司基於機械擠壓穿孔技術開發的創新遞送平臺,正為這一領域帶來全新解決方案。
什麽是Portal機械擠壓穿孔技術?
Portal創新遞送平臺采用基於物理原理的機械擠壓穿孔技術,其工作流程高效且溫和:
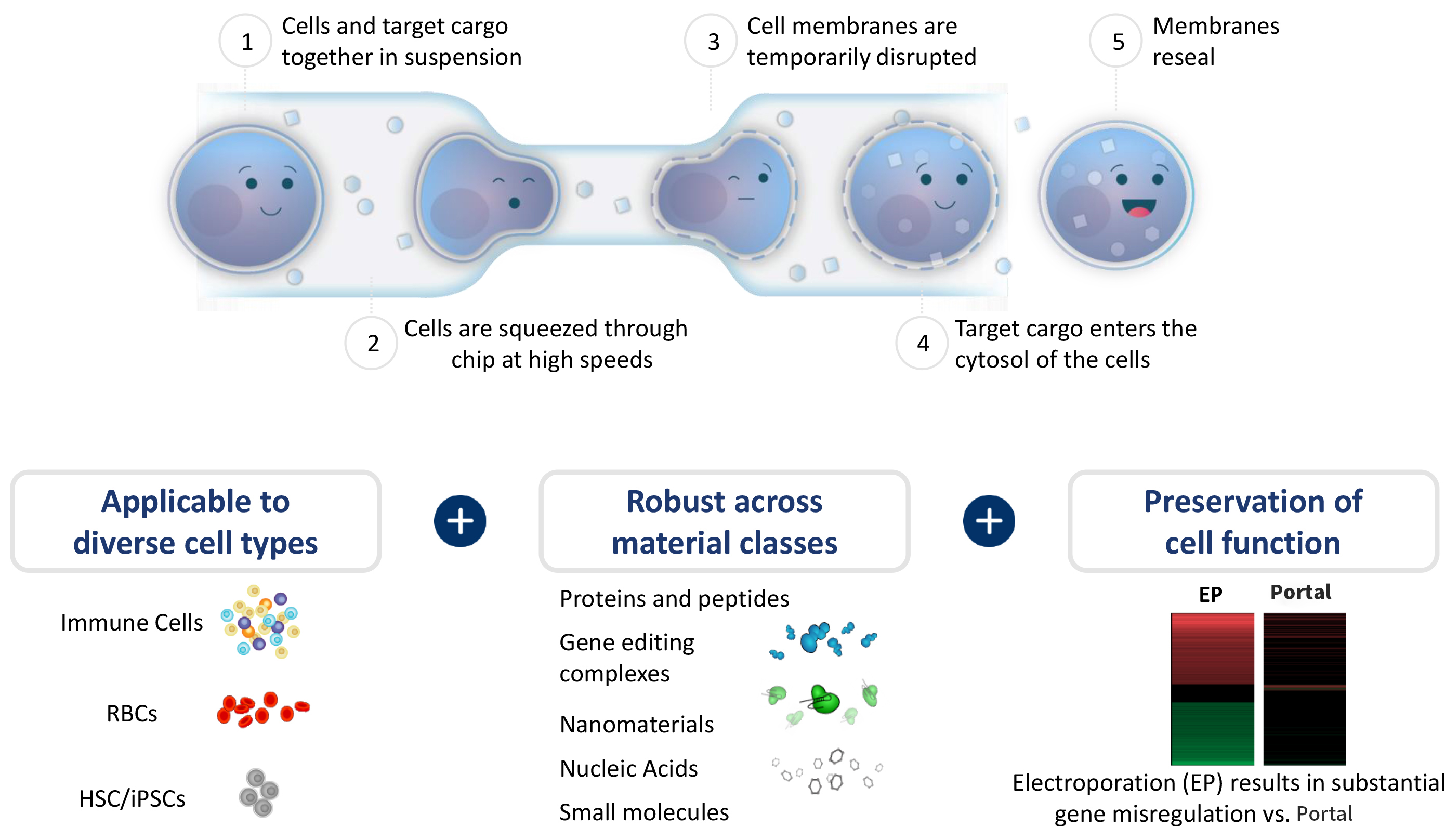
Portal機械擠壓穿孔技術工作原理
混合:將細胞與目標載荷(如 mRNA、RNP等)共同懸浮於溶液中;
擠壓:使細胞快速通過 Portal® 特殊設計的微流控芯片通道(孔徑約為細胞直徑的70%);
進入:細胞在物理擠壓下發生瞬時形變,形成可自我修復的孔隙,周圍目標分子順勢進入細胞質;
恢復:細胞膜迅速修復,細胞恢復完整狀態。
整個過程快速、溫和,無需化學試劑或病毒載體,也避免了電擊對細胞造成的應激與損傷。
為什麽Portal更適合HSCs工程化?
1. 高效遞送多種mRNA與RNP,支持體內外表達
超過90%的HSCs可高效表達轉染的mRNA。
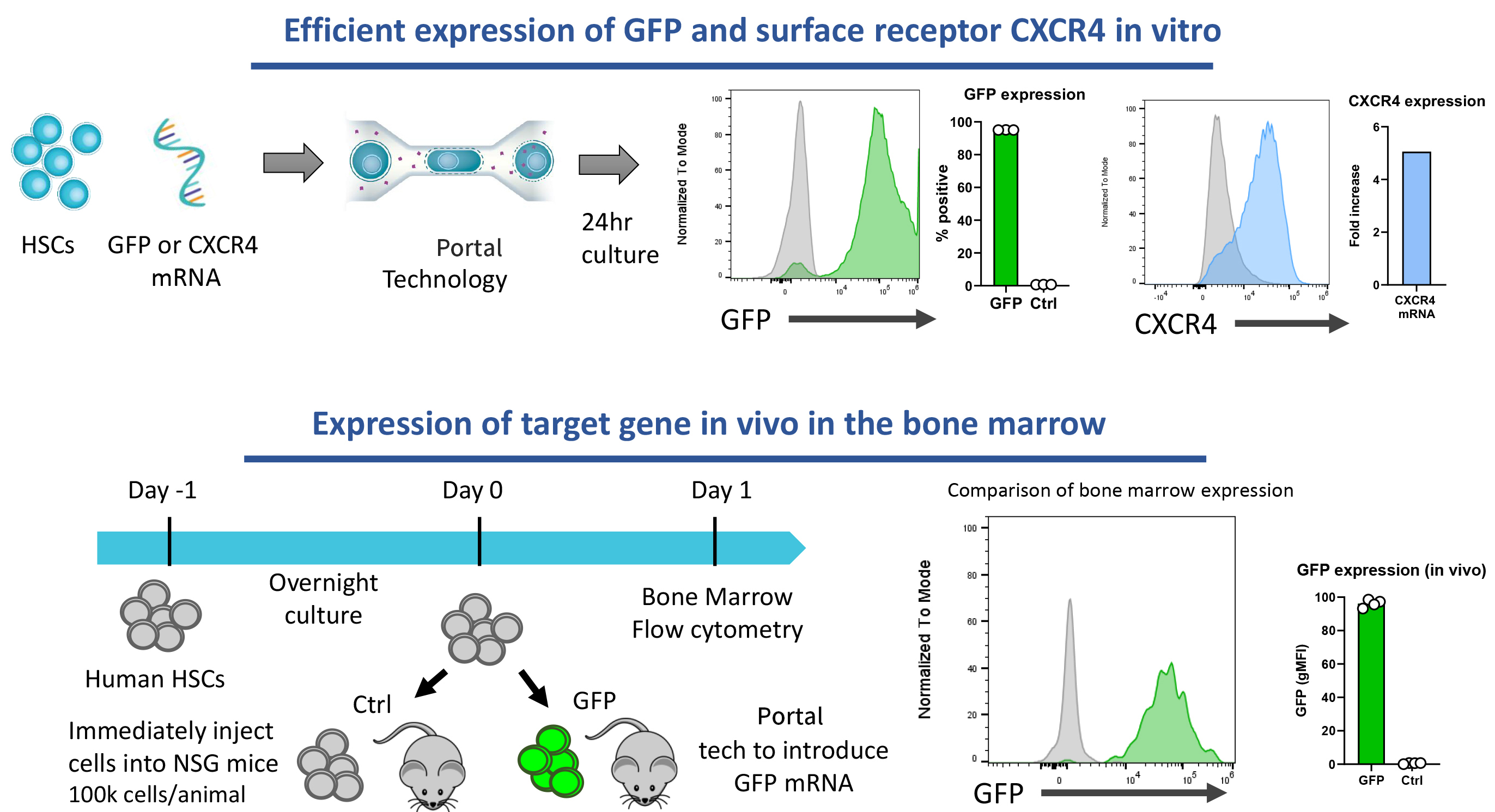
多種mRNA在體內外的高效遞送和表達
2. 更大限度保持細胞表型與功能
經微陣列分析、CFC測定和NBSGW小鼠移植研究證實,Portal處理的CD34+細胞在行為上與未處理組高度一致;
相比之下,電穿孔易導致基因表達失調、集落形成下降、植入率降低及分化能力受損;
遞送抗B2M和抗CCR5 RNPs時,CD34+細胞可實現高編輯率。
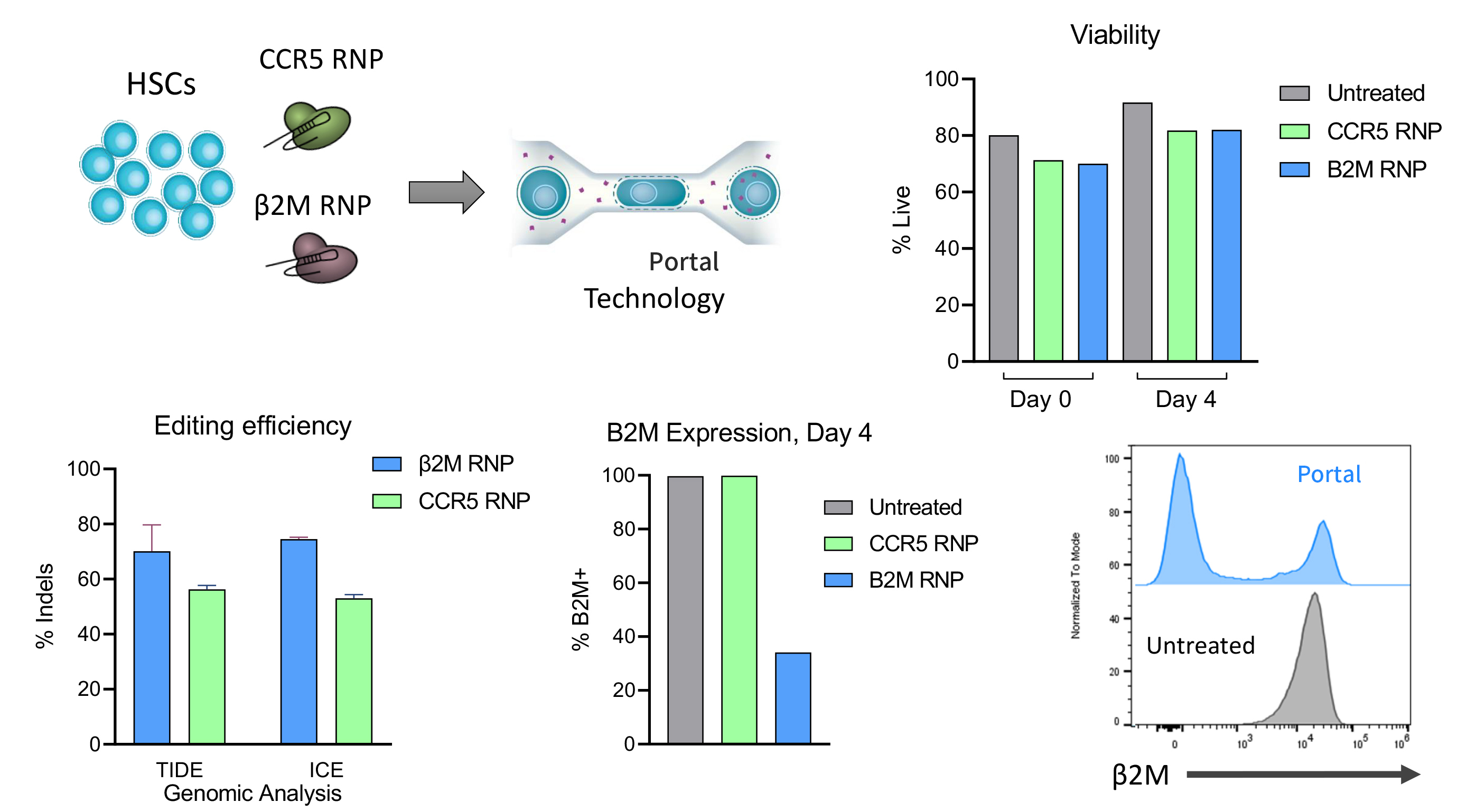
Portal對細胞存活率幾乎沒有影響
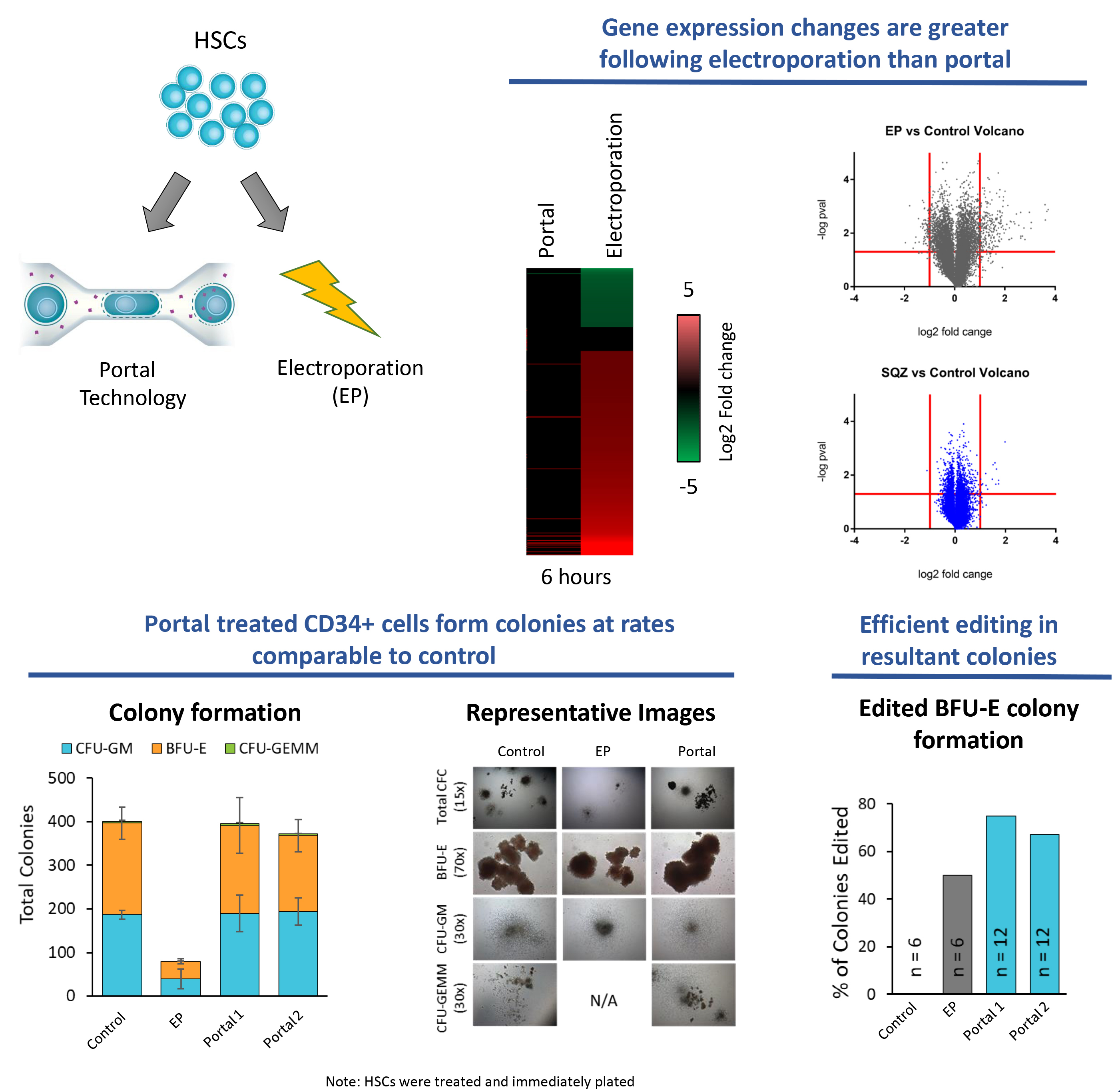
Portal對細胞表型和分化能力幾乎沒有影響
3. 處理後細胞可立即使用,大幅縮短製備周期
無需恢復培養,可直接用於移植,顯著減少體外操作時間;
更符合臨床「床旁即時使用」(point-of-care)需求。
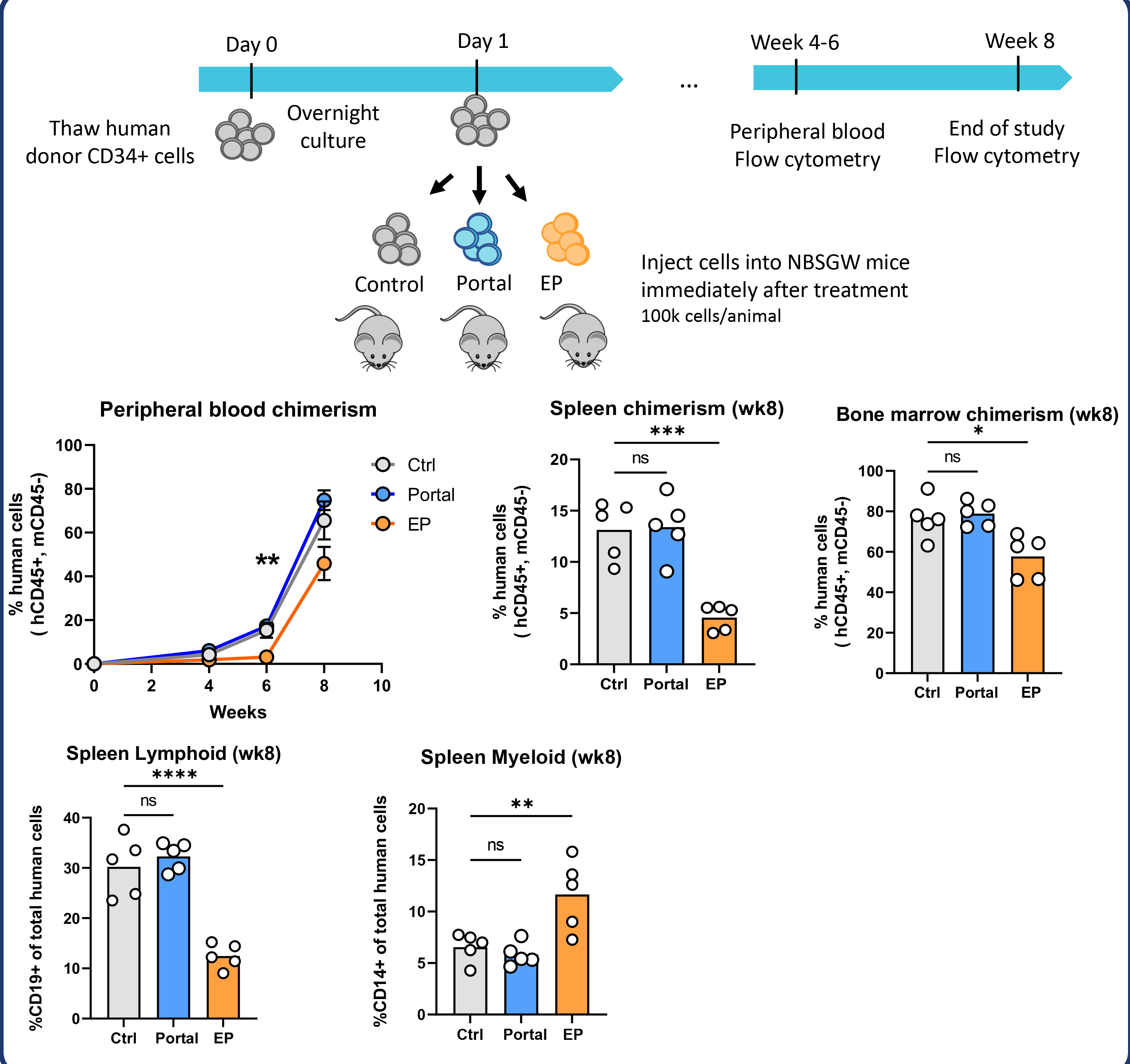
治療後立即高效輸入Portal處理的造血幹細胞
Portal是人類原代CD34+細胞進行mRNA轉染或基因編輯的理想技術方案,不僅可實現高效細胞改造,還可快速投入臨床應用,助力建立更貼近患者的HSC治療新範式。
產品矩陣:覆蓋研發至臨床的全鏈條需求
1. Gateway™ :科研級細胞遞送系統
專為細胞基因治療研發設計,支持CRISPR RNP、mRNA、蛋白質等多樣化遞送。適用於免疫細胞、幹細胞等難轉染細胞,顯著提升基因編輯效率。
2. Galaxy™ :高通量細胞遞送系統
可與自動化平臺無縫集成,滿足大規模化合物篩選需求,助力藥企快速篩選有效候選藥物,降低研發成本與時間。
3. GMP級模塊化耗材(MilliBooster等)
支持臨床級細胞治療生產,兼容第三方GMP設備,推動產業化進程。
應用前景:推動更接近臨床的HSC治療新模式
Portal創新遞送平臺不僅適用於mRNA和RNP,還可高效遞送蛋白質、小分子、納米材料等多種生物材料,具備廣泛的應用潛力。該技術有望實現:
快速、規模化的細胞工程化;
體外停留時間更短,降低細胞應激;
更優的細胞存活率與功能維持,進一步提升治療效果。
憑借高效、溫和與多用途的特性,Portal技術為造血幹細胞基因編輯與細胞治療提供了一條更可靠、更貼近臨床的創新路徑。我們期待該技術未來能夠推動更多遺傳病及癌癥細胞治療項目的落地,惠及廣大患者。
了解更多信息,歡迎關註我們,獲取細胞工程與基因治療領域的前沿進展。



